In a recently published study spearheaded by Giovanny Fuentevilla-Álvarez and his team at the National Institute of Cardiology in Mexico, researchers have significantly advanced the diagnostic precision for Marfan syndrome (MFS) and a spectrum of connective tissue disorders. This comprehensive study, involving 136 Mexican patients, leverages the latest in genetic multipanel testing and next-generation sequencing to unravel the complex interplay between genotype and phenotype in these multifaceted conditions. The study not only highlights the diversity of genetic mutations present in these disorders but also sets a new standard for diagnosing and managing them with a more personalized approach.
Marfan Syndrome: An Overview
Marfan syndrome (MFS) is a complex genetic disorder impacting connective tissue and presenting with a wide range of manifestations in the skeletal, ocular, and cardiovascular systems.
Named after Antoine Marfan, the French pediatrician who first described the condition in 1896, MFS affects connective tissue, providing essential support and elasticity to various body parts. Despite its genetic basis, the syndrome’s effects are wide-ranging, leading to diverse manifestations within individuals and families.
The primary cause of MFS is mutations in the FBN1 gene, responsible for producing fibrillin-1. This condition follows an autosomal dominant inheritance pattern, meaning a single altered FBN1 gene copy can lead to the disorder. Notably, about 25% of cases arise from spontaneous mutations, with no prior family history.
MFS is characterized by:
- Cardiovascular issues: Aortic dilation poses the greatest risk, potentially leading to life-threatening complications like dissection and rupture. Valve malfunctions, including mitral and tricuspid valve prolapse, are also prevalent.
- Skeletal abnormalities: Common features include a tall, slender body, long extremities, scoliosis, and chest deformities, reflecting the syndrome’s impact on skeletal structure.
- Ocular complications: Lens dislocation (ectopia lentis) is a signature issue, alongside other problems such as myopia and retinal detachment.
Diagnosis relies on the Ghent nosology, which combines major and minor criteria across affected systems. Genetic testing, particularly for FBN1 mutations, plays a crucial role in confirming MFS, especially in cases where clinical presentation is ambiguous.
While no cure exists, management strategies focusing on cardiovascular risk monitoring, surgical interventions for severe complications, and comprehensive support can significantly improve outcomes. Medications like beta-blockers, regular monitoring through imaging, and targeted surgeries for aortic and valve issues are central to treatment plans.
A Novel Approach to Diagnosis: The Genetic Panel
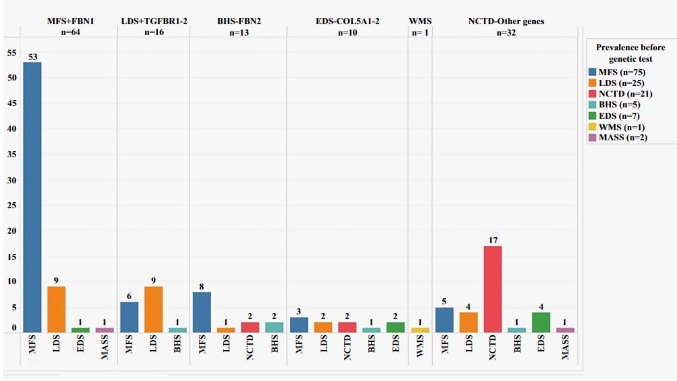
The research team at the National Institute of Cardiology in Mexico, led by Giovanny Fuentevilla-Álvarez et al., investigated the diagnostic potential of connective tissue disorders through a genetic multipanel that included 174 genes associated with cardiovascular diseases, cardiomyopathies, arrhythmias, and structural heart diseases. The study cohort consisted of 136 patients who were initially evaluated and classified based on the 2010 Ghent criteria, necessitating a comprehensive diagnostic process involving extensive imaging studies and genetic testing.
Patients were selected for this prospective observational study based on their clinical presentation and family history, with a significant number undergoing comprehensive cardiovascular evaluations through echocardiography, MRI, or CT scans. Those requiring surgical interventions for aortic dissection or dilation were closely examined to correlate genetic mutations with the severity of cardiovascular conditions, providing invaluable insights into the genetic underpinnings of disease progression and therapeutic outcomes.
The genetic multipanel revealed a significant variability in mutations, leading to a reclassification of many patients’ initial diagnoses. Notably, the study uncovered a prevalent frameshift mutation in the TGFBR2 gene among Loeys–Dietz syndrome patients, a finding that underscores the critical role of genetic testing in identifying specific mutations linked to severe cardiovascular conditions. Furthermore, the high prevalence of severe mutations, such as frameshift indels and stop codons, especially among patients requiring complex surgical interventions, highlights the importance of genetic analysis in guiding clinical decision-making and personalized treatment plans.
Giovanny Fuentevilla-Álvarez, the study‘s lead author, remarked, “Our findings brighten the vast genetic diversity underlying Marfan syndrome and related disorders. By employing a comprehensive genetic panel, we are not just diagnosing diseases; we are unlocking the door to personalized medicine that caters to the unique genetic makeup of each patient.”
Senior author Ricardo Gamboa added, “This study marks a paradigm shift in how we approach connective tissue disorders. The intricate relationship between genetic mutations and clinical manifestations challenges us to rethink our diagnostic and therapeutic strategies, making patient-specific genetic information a cornerstone of effective management.”
Step Forward to Personalized Treatment of Marfan Syndrome
The study‘s implications extend far beyond the immediate findings. By demonstrating the utility of genetic panels in diagnosing connective tissue disorders, the research advocates for a more integrated approach that combines clinical evaluation with detailed genetic analysis. This not only enhances diagnostic accuracy but also paves the way for targeted therapies that address the genetic root of these conditions.
The innovative use of a genetic multipanel in the classification and management of Marfan syndrome and related disorders represents a significant leap forward in personalized medicine. By illuminating the complex genotype–phenotype relationships, this study offers a blueprint for the future of diagnosis and treatment in the field of connective tissue disorders. Moving forward, the integration of comprehensive genetic testing into clinical practice promises to not only improve patient outcomes but also to enhance our understanding of these multifaceted diseases.
The translation of the preceding English text in Spanish:
En un estudio recientemente publicado liderado por Giovanny Fuentevilla-Álvarez y su equipo en el Instituto Nacional de Cardiología en México, los investigadores han avanzado significativamente en la precisión diagnóstica para el síndrome de Marfan (MFS) y un espectro de trastornos del tejido conectivo. Este estudio integral, involucrando a 136 pacientes mexicanos, aprovecha lo último en pruebas genéticas de multipanel y secuenciación de próxima generación para desentrañar la compleja interacción entre genotipo y fenotipo en estas condiciones multifacéticas. El estudio no solo destaca la diversidad de mutaciones genéticas presentes en estos trastornos sino que también establece un nuevo estándar para diagnosticar y manejarlos con un enfoque más personalizado.
Síndrome de Marfan: Una Visión General
El síndrome de Marfan (MFS) es un trastorno genético complejo que impacta el tejido conectivo y se presenta con una amplia gama de manifestaciones en los sistemas esquelético, ocular y cardiovascular.
Nombrado así por Antoine Marfan, el pediatra francés que describió por primera vez la condición en 1896, MFS afecta el tejido conectivo, proporcionando soporte esencial y elasticidad a varias partes del cuerpo. A pesar de su base genética, los efectos del síndrome son de amplio alcance, llevando a manifestaciones diversas dentro de individuos y familias.
La causa principal de MFS son mutaciones en el gen FBN1, responsable de producir fibrilina-1. Esta condición sigue un patrón de herencia autosómico dominante, lo que significa que una sola copia alterada del gen FBN1 puede llevar a la enfermedad. Notablemente, alrededor del 25% de los casos surgen de mutaciones espontáneas, sin historial familiar previo.
El MFS se caracteriza por:
- Problemas cardiovasculares: La dilatación aórtica representa el mayor riesgo, potencialmente llevando a complicaciones mortales como disección y ruptura. Las disfunciones de válvulas, incluyendo prolapso de la válvula mitral y tricúspide, también son comunes.
- Anormalidades esqueléticas: Características comunes incluyen un cuerpo alto y delgado, extremidades largas, escoliosis y deformidades torácicas, reflejando el impacto del síndrome en la estructura esquelética.
- Complicaciones oculares: La dislocación del lente (ectopia lentis) es un problema distintivo, junto con otros problemas como miopía y desprendimiento de retina.
El diagnóstico se basa en la nosología de Gante, que combina criterios mayores y menores en sistemas afectados. Las pruebas genéticas, particularmente para mutaciones FBN1, juegan un papel crucial en confirmar MFS, especialmente en casos donde la presentación clínica es ambigua.
Aunque no existe cura, las estrategias de manejo enfocadas en el monitoreo de riesgos cardiovasculares, intervenciones quirúrgicas para complicaciones severas y soporte integral pueden mejorar significativamente los resultados. Medicamentos como los betabloqueantes, monitoreo regular a través de imágenes y cirugías dirigidas para problemas aórticos y de válvulas son centrales en los planes de tratamiento.
Un Enfoque Novel para el Diagnóstico: El Panel Genético
El equipo de investigación en el Instituto Nacional de Cardiología en México, liderado por Giovanny Fuentevilla-Álvarez et al., investigó el potencial diagnóstico de trastornos del tejido conectivo a través de un panel genético que incluyó 174 genes asociados con enfermedades cardiovasculares, cardiomiopatías, arritmias y enfermedades del corazón estructural. El grupo de estudio consistió en 136 pacientes que inicialmente fueron evaluados y clasificados basados en los criterios de Gante de 2010, necesitando un proceso diagnóstico integral que involucraba estudios de imágenes extensos y pruebas genéticas.
Los pacientes fueron seleccionados para este estudio observacional prospectivo basado en su presentación clínica e historial familiar, con un número significativo sometido a evaluaciones cardiovasculares completas a través de ecocardiografía, resonancia magnética
o escáneres de CT. Aquellos que requerían intervenciones quirúrgicas para disección o dilatación aórtica fueron examinados de cerca para correlacionar las mutaciones genéticas con la severidad de las condiciones cardiovasculares, proporcionando percepciones invaluables sobre las bases genéticas del progreso de la enfermedad y los resultados terapéuticos.
El panel genético reveló una variabilidad significativa en las mutaciones, llevando a una reclasificación de muchos diagnósticos iniciales de los pacientes. Notablemente, el estudio descubrió una mutación de cambio de marco prevalente en el gen TGFBR2 entre los pacientes con síndrome de Loeys-Dietz, un hallazgo que subraya el papel crítico de las pruebas genéticas en identificar mutaciones específicas vinculadas a condiciones cardiovasculares severas. Además, la alta prevalencia de mutaciones severas, como indels de cambio de marco y codones de parada, especialmente entre pacientes que requieren intervenciones quirúrgicas complejas, resalta la importancia del análisis genético en guiar la toma de decisiones clínicas y los planes de tratamiento personalizados.
Giovanny Fuentevilla-Álvarez, el autor principal del estudio, comentó: “Nuestros hallazgos iluminan la vasta diversidad genética subyacente al síndrome de Marfan y trastornos relacionados. Al emplear un panel genético integral, no solo estamos diagnosticando enfermedades; estamos abriendo la puerta a la medicina personalizada que atiende al maquillaje genético único de cada paciente.”
Ricardo Gamboa, el autor senior, agregó: “Este estudio marca un cambio de paradigma en cómo abordamos los trastornos del tejido conectivo. La compleja relación entre mutaciones genéticas y manifestaciones clínicas nos desafía a repensar nuestras estrategias diagnósticas y terapéuticas, haciendo de la información genética específica del paciente una piedra angular del manejo efectivo.”
Avance hacia el Tratamiento Personalizado del Síndrome de Marfan
Las implicaciones del estudio van más allá de los hallazgos inmediatos. Al demostrar la utilidad de los paneles genéticos en el diagnóstico de trastornos del tejido conectivo, la investigación aboga por un enfoque más integrado que combina la evaluación clínica con un análisis genético detallado. Esto no solo mejora la precisión diagnóstica sino que también abre el camino para terapias dirigidas que abordan la raíz genética de estas condiciones.
En conclusión, el uso innovador de un panel genético en la clasificación y manejo del síndrome de Marfan y trastornos relacionados representa un salto significativo hacia adelante en la medicina personalizada. Al arrojar luz sobre las complejas relaciones genotipo-fenotipo, este estudio proporciona un plano para el futuro del diagnóstico y tratamiento en el campo de los trastornos del tejido conectivo. A medida que avanzamos, la integración de pruebas genéticas integrales en la práctica clínica promete no solo mejorar los resultados de los pacientes sino también profundizar nuestra comprensión de estas enfermedades multifacéticas.
Reference: Fuentevilla-Álvarez G, Soto ME, Torres-Paz YE, Meza-Toledo SE, Vargas-Alarcón G, González-Moyotl N, et al. The usefulness of the genetic panel in the classification and refinement of diagnostic accuracy of Mexican patients with Marfan syndrome and other connective tissue disorders . Biomol Biomed [Internet]. 2023 Sep. 8 [cited 2024 Feb. 9];. Available from: https://www.bjbms.org/ojs/index.php/bjbms/article/view/9578
Editor: Ermina Vukalic
Leave a Reply